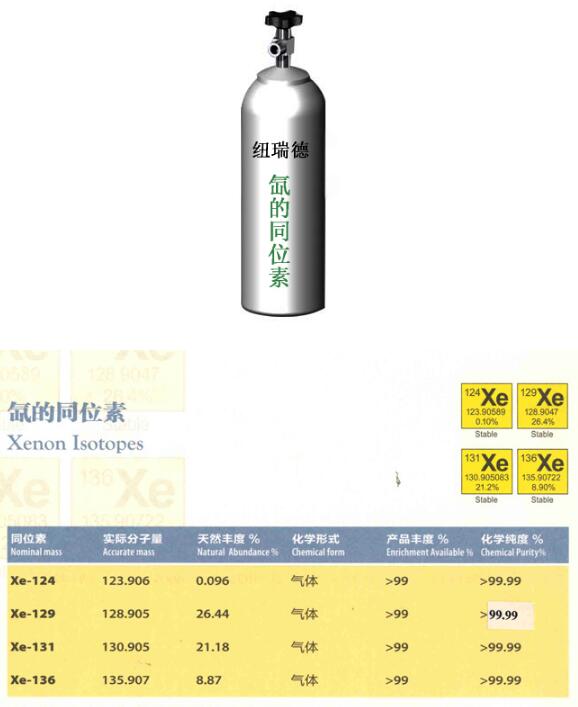
氙同位素中,110xe至147xe均被实验室制得,其中能稳定存在的是124xe,126xe,128xe~132xe,134xe与136xe,自然界中丰度最大的是132xe。
稳定的氙同位素有9种,分别是氙124、126、128、129、130、131、132、134、136,都没有放射性。
稳定氙同位素应用:
124xe:可用于碘的两种放射性同位素生产,l-123和i-125。
129xe:用于肺部气流的磁共振成像。
131xe:可以用任核磁共振信号或ct信号的增强剂。
136xe:建议用做无中微子双贝塔误变研究的挥测器。
氙在地壳中的含量极少,主要来源于空气;相对原子量为131.3,临界温度为,16.6。氙气无色,不助燃,能吸收=射线x射线,是相对原子质量最大,密度最大的天然气体。利用高速气体离心机可以有效地进行氙同位素的生产。
相关知识:
同位素是具有相同质子数,不同中子数的同一元素的不同核素互为同位素(isotope)。
同位素是具有相同原子序数的同一化学元素的两种或多种原子之一,在元素周期表上占有同一位置,化学行为几乎相同,但原子量或质量数不同,从而其质谱行为、放射性转变和物理性质(例如在气态下的扩散本领)有所差异。同位素的表示是在该元素符号的左上角注明质量数(质子数 中子数),左下角注明质子数。 例如碳14,一般用14c而不用c-14。
自然界中许多元素都有同位素。同位素有的是天然存在的,有的是人工制造的,有的有放射性,有的没有放射性。
同一元素的同位素虽然质量数不同,但他们的化学性质基本相同(如:化学反应和离子的形成),物理性质有差异[主要表现在质量上(如:熔点和沸点)]。自然界中,各种同位素的原子个数百分比一定。
在自然界中天然存在的同位素称为天然同位素,人工合成的同位素称为人造同位素。如果该同位素是有放射性的话,会被称为放射性同位素。每一种元素都有放射性同位素。有些放射性同位素是自然界中存在的,有些则是用核粒子,如质子、a粒子或中子轰击稳定的核而人为产生的。
武汉纽瑞德高纯氙气、进口氙气、氙气同位素、高纯凯发·k8国际(中国)首页登录、六氟化硫有售,瓶瓶检验,价格最低,全国配送,咨询电话:400-6277-838